Paramagnetismus
Einleitung
Die ersten paramagnetischen Sauerstoffsensoren entstanden bereits in den 1930er Jahren in Deutschland und basierten auf den thermischen Eigenschaften magnetischer Stoffe1 . Die Entdeckung dieses Effektes kam wahrscheinlich eher durch einen Zufall zustande, als man den Einfluss magnetischer Felder auf die Wärmeleitfähigkeit untersuchte. Beim Sauerstoff wurde eine erhebliche Abhängigkeit der Messspannung beobachtet, die nicht auf die Wärmeleitfähigkeitsänderung durch das Magnetfeld zurückzuführen war. Man hatte einen neuen Messeffekt entdeckt. Die ersten Aufbauten zur Sauerstoffmessung bestanden daher aus Wärmeleitfähigkeitssensoren, bei denen sich die Messzelle in einem starken magnetischen Feld befand. In den 1940/50er wurden weitere Verfahren auf dieser Basis entwickelt und auch erstmalig theoretisch beschrieben2.
Grundlagen
Die magnetischen Eigenschaften von Gasen, sind im Vergleich zu ferromagnetischen Materialien (z.B. Eisen), klein. Schwach magnetische Eigenschaften werden als paramagnetisch und diamagnetisch bezeichnet. Paramagnetische Stoffe haben ein permanentes, magnetisches Dipolmoment m. Ohne ein äußeres Magnetfeld sind die Moleküle ungeordnet, so dass keine magnetischen Einflüsse erkennbar sind. Wird jedoch ein äußeres Magnetfeld H angelegt, so richten sich Moleküle aus und werden von dem Magnetfeld angezogen. Es entstehen also Kraftwirkungen, die für eine Gasmessung genutzt werden können. Diamagnetische Stoffe haben kein permanentes Dipolmoment. In einem äußeren Magnetfeld werden aber magnetische Dipole erzeugt, die allerdings dem Magnetfeld entgegengerichtet sind. Diese Stoffe schwächen also das Magnetfeld und werden daher abgestoßen. Diamagnetische Stoffe haben in der Gasmesstechnik keine Bedeutung.
Die magnetischen Eigenschaften paramagnetischer Stoffe werden über die magnetische Permeabilität µ beschrieben. Die relative Permeabilität µr ergibt sich aus der magnetischen Feldkonstanten µ0=4π·10-7 T·m/A:
(1) μr =
Ein weiterer wichtiger Parameter ist die magnetische Suszeptibilität χm, die wie folgt definiert ist:
(2) χm = μr-1
Für paramagnetische Stoffe ist µr>1 und χm>1, während für diagmagnetische Stoffe µr<1 und χm<1 gilt. Die magnetische Flussdichte (Induktion) B ergibt sich aus:
(3) B = μ0 · μr · H
Eine weitere nützliche Größe ist die Magnetisierung M, die als das magnetische Dipolmoment pro Volumeneinheit definiert ist:
(4) M =
Die Magnetisierung ist proportional zum Magnetfeld B und umgekehrt proportional zur Temperatur T(in K). Dieser Zusammenhang wird auch als das Curie3 -Gesetz bezeichnet:
(5) M = C ·
Der Proportionalfaktor C ist die sogenannte Curie-Konstante. Mit steigender Temperatur verlieren die Stoffe demnach ihre magnetischen Eigenschaften. Auch dieser Zusammenhang lässt sich zur Gasmessung nutzen.
In Tabelle 1 sind die Suszeptibilitäten χmol. von verschiedenen Gasen aufgeführt. In dieser Liste hat Sauerstoff die mit Abstand größte Suszeptibilität, gefolgt von Stickstoffmonoxid (NO). Paramagnetische Messverfahren werden daher bevorzugt zur Messung von Sauerstoff eingesetzt, da Störungen (Querempfindlichkeiten) durch die anderen Gase nahezu ausgeschlossen werden können.
Tabelle 1: Molare Suszeptibilität χmol. und relative Suszeptibilität χrel. verschiedener Gase
| Gas |
χmol. · 10-9m3/mol |
χrel.[02 = 100%] |
| Sauerstoff |
43,34 |
100 |
| Stickstoffmonoxiod |
18,36 |
42,4 |
| Stickstoffdioxid |
1,88 |
4,33 |
| Distickstoffmonoxiod |
-0,24 |
-0,55 |
| Helium |
-0,025 |
-0,06 |
| Wasserstoff |
-0,05 |
-0,12 |
| Neon |
-0,057 |
-0,13 |
| Stickstoff |
-0,15 |
-0,35 |
| Wasserdampf |
-0,16 |
-0,37 |
| Kohlenmonoxid |
-0,12 |
-0,28 |
| Kohlendioxid |
-0,26 |
-0,60 |
| Argon |
-0,24 |
-0,55 |
In einem Gasgemisch (Konzentration c) ändert sich die Suszeptibilität χM gemäß der Mischungsregel:
(6) χM = χ1 · c1 + χ2 · c2 + ··· + χn · cn
Diese Querempfindlichkeit kann also in den meisten Fällen vernachlässigt werden, so dass man bei der paramagnetischen Sauerstoffmessung von einem selektiven Messverfahren sprechen kann. In der chemischen Verfahrenstechnik können hingegen hohe NO-Konzentrationen im Vol.-%-Bereich vorkommen, die dann einen entsprechend größeren Fehlereinfluss haben. Stickstoffmonoxid NO lässt sich daher in hohen Konzentrationen auch mit dem paramagnetischen Messverfahren überwachen.
Magnetomechanisches Verfahren
Dieses Verfahren ist seit 1940 bekannt und basiert auf einer magnetischen Drehwaage4. Der Aufbau besteht aus zwei dünnwandigen Glaskugeln (d ≈ 3mm), die mit einem ca. 4 mm langen Glasstab verschmolzen sind. Die Suszeptibilität χK der Glaskugeln ergibt sich aus dem Glasmaterial und der Gasfüllung (z.B. N2). Die Masse m der Glaskugeln beträgt wenige mg. Diese Anordnung sieht aus wie eine Hantel, daher spricht man gelegentlich auch von dem Hantel-Verfahren (engl. Dumbbell). Beide Kugeln befinden sich in einem inhomogenen Magnetfeld H und werden über ein Torsionsband in der Mitte zwischen den Kugeln gehalten (Abb.1). Um die beiden Kugeln befindet sich weiterhin eine Stromschleife, die von einem regelbaren Strom IH durchflossen wird. In der Ausgangsposition liegen die Kugeln um einen Betrag ∆x versetzt zu der Mitte des Magnetfeldes H. In dieser Position ist das Torsionsband vorgespannt. In der Messkammer befindet sich noch kein Sauerstoff. Um die Hantel in ihrer Position zu halten, fließt bereits ein Grundstrom IH, der ein entgegengesetztes magnetisches Feld H aufbaut. Das magnetische Feld H lässt sich wie folgt berechnen:
(7) H =
Da sich die Schleife in einem äußeren Magnetfeld befindet, entsteht eine Kraft F die proportional zum Magnetfeld H ist. Der Proportionalfaktor δ ergibt sich aus der geometrischen Anordnung und der Feldstärke des Permanentmagneten:
(8) F3 = F4 = δ · H
Dieses H-Feld erzeugt ein Drehmoment, das dem Torsionsband-Drehmoment MTorsion entgegengerichtet ist. Beide Drehmomente heben sich dann in der Ruhelage auf. Durch diese Maßnahme ist gewährleistet, dass sich die Hantel immer an einer definierten Stelle befindet und durch Erschütterungen und Vibrationen nicht beliebig verstellen kann. Es gilt:
(9) MTorsion = F3 · + F4 ·
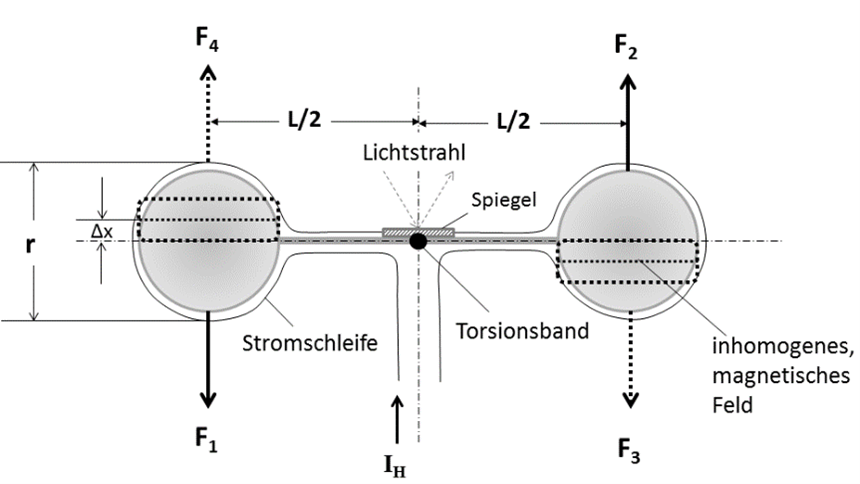 Abb. 1: Aufbau der Hantel mit den unterschiedlichen Kräften, die zu einem resultierendes Drehmoment führen. Die Stromschleife wird zur Kompensation dieser Drehbewegung eingesetzt.
Abb. 1: Aufbau der Hantel mit den unterschiedlichen Kräften, die zu einem resultierendes Drehmoment führen. Die Stromschleife wird zur Kompensation dieser Drehbewegung eingesetzt.
Wird nun Sauerstoff in die Messkammer eingeleitet, so werden die O2-Moleküle versuchen, durch die Kraftwirkung des inhomogenen Magnetfeldes, an die Position der Glaskugeln, zu gelangen. Durch diesen Verdrängungseffekt der O2-Moleküle entstehen weitere Kräfte (F1 und F2), die ein zusätzliches Drehmoment M hervorrufen. Da diese Kräfte direkt proportional zur Sauerstoffkonzentration sind, gilt dies auch für die Drehmomente. Die Gleichung für das Drehmoment MO2, das auf den Torsionsfaden wirkt, lässt sich für eine Gasmischung mit der Suszeptibilität χM wie folgt berechnen:
(10) M02 = (χM-χK) · V · μ0 · H · L ·
Die auftretenden Drehmomente liegen in der Größenordnung von 10-10Nm. Ohne weitere Maßnahme würde sich die Hantel also bewegen und den nachdrängenden O2-Molekülen Platz machen. Dieser Vorgang wird von einer optischen Abtastung über einen kleinen Spiegel in der Mitte der Hantel erfasst und führt über eine Regelelektronik zu einer Erhöhung des Hantel-Stromes IH. Diese Erhöhung ist absolut proportional zum Sauerstoffgehalt cO2 und dient als Maß für die Konzentrationsangabe.
Die optische Abtastung erfolgt mit einer Differenz-Fotodiode (Abb. 3.6.9). Bewegt sich die Hantel, aufgrund einer steigenden oder sinkenden Sauerstoffkonzentration, ändern sich auch die Strahlungsanteile der beiden Empfangsdioden und der Schleifenstrom IH muss entsprechend nachgeregelt werden. Dieser Regelvorgang ist dann abgeschlossen, wenn beide Strahlungsanteile wieder identisch sind (Kompensationsverfahren). Der Vorteil dieser Methode ist der absolut lineare Zusammenhang zwischen der O2- Konzentration und dem Schleifenstrom IH. Eine zusätzliche Linearisierung der Signale ist daher nicht erforderlich. Die unterschiedlichen Hersteller bieten Messbereiche von 0-1 Vol.-% O2 bis 0-100 Vol.%-O2 an.
Der Durchfluss ist aber auch bei diesen Aufbauten auf 0,3 L/Min. begrenzt, um die Hantelposition nicht durch turbulente Strömungen in der Kammer zu stören. Für größere Durchflüsse werden Bypass-Lösungen eingesetzt. Typische Temperatureinsatzbereiche liegen bei 0 bis 45°C, mit integrierter Thermostatisierung der Messzelle auf 50°C. Das zeitliche Ansprechverhalten ist schnell und liegt im Bereich von 2 Sekunden.
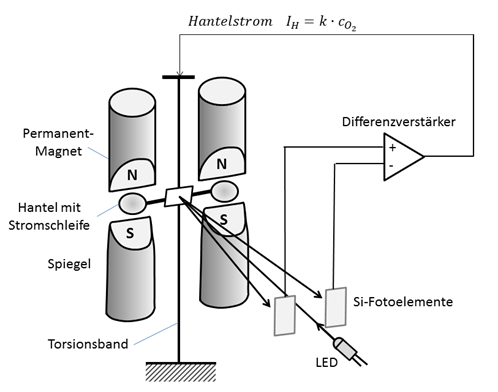 Abb. 2: Prinzipieller Aufbau des magnetomechanischen Sauerstoffmessverfahrens. Die Abtastung der Hantelposition erfolgt mit einer fokussierten LED-Optik und einer Differenz-Fotodiode.
Abb. 2: Prinzipieller Aufbau des magnetomechanischen Sauerstoffmessverfahrens. Die Abtastung der Hantelposition erfolgt mit einer fokussierten LED-Optik und einer Differenz-Fotodiode.
 Abb. 3: Paramagnetischer Sauerstoffsensor der Bauart PMA Transmitter
Abb. 3: Paramagnetischer Sauerstoffsensor der Bauart PMA Transmitter
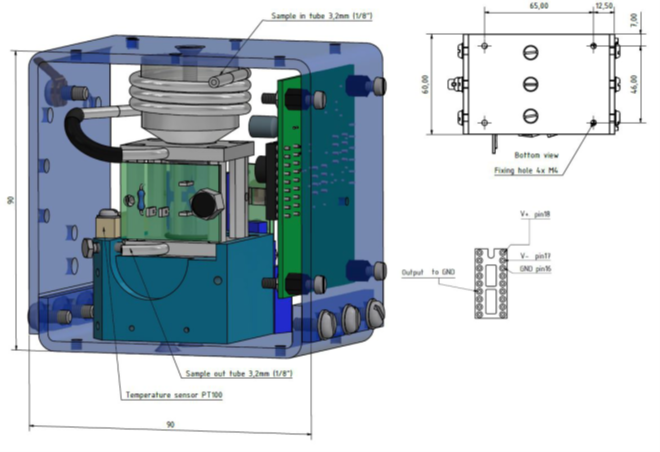 Abb. 4: Abmessungen des PMA Transmitters in mm und elektrische Anschlüss
Abb. 4: Abmessungen des PMA Transmitters in mm und elektrische Anschlüss
Technische Daten
| Elektr. Anschluss |
18-pin DIL-Stecker |
| Einstellzeit für 90 % Wert |
< 3 Sekunden bei 60 Nl/h |
| Einfluss des barometrischen Druckes |
Die O2-Anzeige ändert sich proportional mit dem barometrischen Druck. |
| |
|
| Messgaseingangsdruck |
min. 0,01 bar, max. 1 bar |
| Messgasausgangsdruck |
Das Messgas muss drucklos zur Atmosphäre abströmen |
| |
|
| Umgebungs- / Messgastemperatur |
-10 °C bis +55 °C |
| Lagertemperatur |
-20 °C bis +60 °C |
| Umgebungsfeuchtigkeit |
0-95 % R.F. |
| Medium berührte Werkstoffe |
Platin, Glas, Edelstahl 1.4571, Viton, Polypropylen, Epoxy |
| |
|
| Messgasanschlüsse |
Rohr 1/8“(3,2 mm Außendurchmesser) |
| Abmessungen |
90 x 96,5 x 60 mm (H x B x L) |
| Gewicht |
1 kg |
| Gas |
Summen-Formel |
20°C |
50°C |
| Acetaldehyd |
C2H4O |
-0,31 |
-0,34 |
| Aceton |
C3H6O |
-0,63 |
-0,69 |
| Acetylen |
C2H2 |
-0,26 |
-0,28 |
| Ammoniak |
NH3 |
-0,17 |
-0,19 |
| Argon |
Ar |
-0,23 |
-0,25 |
| Benzol |
C6H6 |
-1,24 |
-1,34 |
| Brom |
Br2 |
-1,78 |
-1,97 |
| Butadien |
C4H6 |
-0,85 |
-0,93 |
| n-Butan |
C4H10 |
-1,10 |
-1,22 |
| Iso-Butylen |
C4H7 |
-0,94 |
-1,06 |
| Chlor |
CI2 |
-0,83 |
-0,91 |
| Diacetylen |
(CHCI)2 |
-1,09 |
-1,20 |
| Distickstoffmomoxid |
N2O |
-0,20 |
-0,22 |
| Ethan |
C2H4 |
-0,43 |
-0,47 |
| Ethylbenzol |
C8H10 |
-1,89 |
-2,08 |
| Ethylen |
C2H4 |
-0,20 |
-0,22 |
| Ethylenglycol |
(CH2OH)2 |
-0,78 |
-0,88 |
| Ethylenoxid |
C2H4O2 |
-0,54 |
-0,60 |
| Furan |
C4H4O |
-0,90 |
-0,99 |
| Helium |
He |
0,29 |
0,32 |
| n-Hexan |
C6H14 |
-1,78 |
-1,97 |
| Hydrogenchlorid |
HCL |
-0,31 |
-0,34 |
| Hydrogenfluorid |
HF |
0,12 |
0,14 |
| Hydrogensulfid |
H2S |
-0,41 |
-0,43 |
| Kohlendioxid |
CO2 |
-0,27 |
-0,29 |
| Kohlenmonoxid |
CO |
-0,06 |
-0,07 |
| Krypton |
Kr |
-0,49 |
-0,54 |
| Methan |
CH4 |
-0,16 |
-0,17 |
| Methanol |
CH4O |
-0,27 |
-0,31 |
| Methylenchlorid |
CH2CI2 |
-1,00 |
-1,10 |
| Methylpropen |
C4H8 |
-0,94 |
-1,06 |
| Monosilan |
SiH4 |
-0,24 |
-0,27 |
| Neon |
Ne |
0,16 |
0,17 |
| n-Octan |
C8H18 |
-2,45 |
-2,70 |
| Phenol |
C6H6O |
-1,40 |
-1,54 |
| Propan |
C3H8 |
-0,77 |
-0,85 |
| Propylen |
C3H6 |
-0,57 |
-0,62 |
| Propylenchlorid |
C3H7CI |
-1,42 |
-1,44 |
| Propylemoxid |
C3H6O |
-0,90 |
-1,00 |
| Sauerstoff |
O2 |
100 |
100 |
| Schwefeldioxid |
SO2 |
-0,18 |
-0,20 |
| Schwefelhexafluorid |
SF6 |
-0,98 |
-1,05 |
| Silan |
SiH4 |
-0,24 |
-0,27 |
| Stickstoff |
N2 |
0 |
0 |
| Stickstoffdioxid |
NO2 |
5 |
16 |
| Stickstoffmonoxid |
NO |
42,7 |
43 |
| Styrol |
C8H8 |
-1,63 |
-1,80 |
| Toluen |
C7H8 |
-1,57 |
-1,73 |
| Vinylchlorid |
C2H3CI |
-0,68 |
-0,74 |
| Vinylfluroid |
C2H3F |
-0,49 |
-0,54 |
| Wasser |
H2O |
-0,03 |
-0,03 |
| Wasserstoff |
H2 |
-0,23 |
-0,26 |
| Xenon |
Xe |
-0,95 |
-1,02 |
Berücksichtigung von Querempfindlichkeiten
Die Selektivität des oben genannten Messverfahrens beruht auf der großen Suszeptibilität des Sauerstoffes gegenüber anderen Gasen (s. Tabelle).
Die folgenden Beispiele sollen exemplarisch zeigen, wie Querempfindlichkeiten bei der Nullpunktkalibrierung berücksichtigt werden können.
Beispiel 1: Bestimmung des Rest-Sauerstoffgehaltes in einer 100%-igen Kohlendioxid (CO2) Schutzgasatmosphäre bei 20 °C
Aus der Tabelle für die Querempfindlichkeiten ist für CO2 bei 20 °C ein Wert von -0,27 abzulesen. Das heißt, dass bei einer Kalibrierung mit Stickstoff, der Nullpunkt auf +0,27 % eingestellt werden muss, um die Anzeigenmissweisung in guter Näherung zu kompensieren.
Da es sich in diesem Beispiel ausschließlich um eine Atmosphäre aus CO2 und O2 handelt, kann die Querempfindlichkeit (QE) problemlos eliminiert werden, indem man zur Justage im Nullpunkt anstelle von Stickstoff (N2) Kohlendioxid (CO2) verwendet.
Beispiel 2: Bestimmung des Sauerstoffgehaltes eines Gasgemisches bei 20 °C
- 1 Vol.-% C2H6 (Ethan)
- 5 Vol.-% O2
- 40 Vol.-% CO2
- 54 Vol.-% N2
Nullpunktjustage mit Stickstoff (N2)
Die Querempfindlichkeit (QE) aus obiger Tabelle sind auf 100 Vol.-% des entsprechenden Gases bezogen. Es muss also eine Umrechnung auf die tatsächliche Volumenkonzentration erfolgen. Allgemein gilt:
tatsächliche QE = [Vol.-%]
Für die Komponenten des Gasgemisches ergeben sich somit folgende Werte:
- C2H6: -0,0043 Vol.-%
- CO2: -0,1080 Vol.-%
- N2: -0,0000 Vol.-%
- ∑= -0,1123 Vol.-%
Um möglichst genau die tatsächliche Summe der Querempfindlichkeiten zu ermitteln, muss ein Korrekturfaktor ermittelt werden, da sich die Summe der Querempfindlichkeiten nicht auf 100 % sondern auf 100 % abzüglich der Sauerstoffkonzentration bezieht (hier 95 %). Der Korrekturfaktor errechnet sich:
Korrekturfaktor = [Vol.-%]
Es ergibt sich somit folgender Korrekturfaktor: = 1,0526
Für das Gasgemisch errechnet sich so in guter Näherung die korrigierte Querempfindlichkeit:
1,0526 · (-0,1123 Vol.-%) = -0,1182 Vol.-%
Die korrigierte Querempfindlichkeit mit Vorzeichenwechsel kann nun zur Korrektur bei der Nullpunktkalibrierung verwendet werden. In diesem Beispiel wäre der Nullpunkt auf +0,1182 Vol.-% zu justieren.
Eine Vernachlässigung der Querempfindlichkeiten würde in diesem Beispiel einen relativen Fehler von ca. 2 % bedeuten.
1 Lehrer, E.: Analen der Physik 81,229(1926)
2 Krupp, H.: Dissertation, Technische Hochschule Karlsruhe (1953)
3 Pierre Curie (1859-1906) französischer Physiker
4 Pauling, L., et. al.: J. Amer. Chem. 36, 795 (1946)






