Grundlagen
Um ein Gas bzw. ein Gasgemisch beschreiben (analysieren) zu können muss zunächst einmal bekannt sein, um welche Gase es sich hierbei handelt. Entweder sind diese Gase aus der Anwendung bekannt, oder sie müssen erst bestimmt werden. Hierbei spricht man von der qualitativen Gasanalyse. In der Regel werden hierfür Laboranalysatoren wie GC, MS oder FTIR eingesetzt. Sind die Gase nun bekannt sind jetzt die Mengenverhältnisse bzw. Konzentrationen von Interesse. Hierzu werden sehr unterschiedliche Gasmessverfahren eingesetzt, die auf physikalische und/ oder chemische Methoden basieren. Eine ausführliche Beschreibung dieser Messverfahren findet sich in dem Buch Gasmesstechnik in Theorie und Praxis.
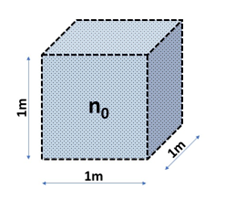
Die Gasmenge wird durch die Anzahl N der Gasmoleküle bzw. Atome charakterisiert, die sich in einem bestimmten Volumen befinden.
Anzahl n0 der Moleküle die sich in 1m3 befinden
Molare Größen
Hinter der makroskopischen Masse m verbirgt sich die Masse der einzelnen Atome bzw. Moleküle multipliziert mit der Anzahl N der Teilchen, die sich in einem bestimmten Volumen V befinden. Unter Normalbedingungen (1013,25 hPa und 273,15 K) enthält jedes Gas die gleiche Anzahl n0 an Molekülen. In einem m³ sind es:
(1) n0 = 2,68678 · 1025m-3
Dieser Zahlenwert wird als Loschmidt -Konstante bezeichnet. Im internationalen Einheitensystem (SI) wird die Einheit Mol (mol) für die Stoffmenge n definiert und gibt die Anzahl der Teilchen an, die in 12 g des Kohlenstoffisotopes C-12 enthalten sind. Diese Zahl wird als Avogadro-Konstante bezeichnet und beträgt:
(2)
Für bestimmte Anwendungen ist es durchaus hilfreich, das Volumen V oder auch die Masse m auf die Stoffmenge n zu beziehen. Dadurch erhält man folgende Größen:
(3) molare Masse M =
(4) molares Volumen Vm =
Die molare Masse M wird in kg/mol bzw. g/mol angegeben und ihr Zahlenwert ist mit der relativen Atommasse bzw. Molekülmasse identisch. Weiterhin gilt für das molare Volumen Vm unter Normalbedingungen folgender Zusammenhang:
(5) molares Normvolumen Vmn = 22,414 = 22,414
Für bestimmte Einsatzbereiche (z.B. physikalische Chemie und Analysentechnik) wird die Zustandsgleichung nicht mit der Masse m, sondern mit der Stoffmenge n berechnet.
(6) p · V = m · Ri · T
Mit der Gl. 6 lässt sich die Masse dann durch m = M · n ausdrücken und die Zustandsgleichung hat dann folgende Form:
(7) p · V = n · M · Ri · T
Das Produkt M · Ri wird als universelle Gaskonstante R bezeichnet und ist stoffunabhängig. Mit dieser universellen Gaskonstante R ändert sich die Zustandsgleichung wie folgt:
(8) p · V = n · M · R · T
Die universelle Gaskonstante R lässt sich wie folgt berechnen, wenn man die Gl. auf die Stoffmenge 1 mol unter Normalbedingungen bezieht:
(9) R = M · Ri = = = = 8,3145
Konzentrationsangaben
Die molare Größe gibt uns einen Aufschluss darüber, wie viele Teilchen sich in einem bestimmten Volumen befinden. Unter Normalbedingungen sind das etwa 6·1023 Teilchen in 22,4 Liter Gasvolumen. In Gasgemischen befinden sich unterschiedliche Komponenten, deren Anteil oder Gehalt eine wichtige messtechnische Größe darstellt. In der Gasmesstechnik ist neben dem gesuchten Stoff (Messgröße) daher auch noch die Konzentration c wichtig. Man unterscheidet daher folgende Angaben:
Maßeinheiten in der Gasanalyse
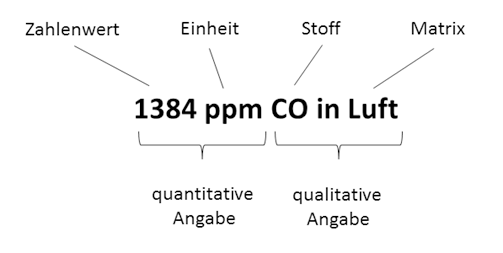
Für die quantitative Angabe haben sich verschieden Einheiten herausgebildet, die sich je nach Anwendung deutlich unterscheiden. Einige Beispiele sind in der nachfolgenden Tabelle aufgelistet:
Tabelle 2.5.4 : Gängige Konzentrationsangabe in der Analysentechnik (Wiegleb 2010)
| Anteil | Volumenangabe | Beispiel | Gewichtsangaben |
|---|---|---|---|
| 10-2 | Prozent [%] | Alkohol im Bier | g/L, g/m3 |
| 10-3 | Prozent [‰] | Alkohol im Blut | mg/L, mg/m3 |
| 10-6 | Parts per million [ppm] | Emmissions-Konzentration | µg/L, µg/m3 |
| 10-9 | Parts per billion [ppb] | Immissions-Konzentrationen | ng/L, ng/m3 |
| 10-12 | Parts per trillion [ppt] | Spurenanalytik und Nachweisempfindlichkeiten von Tieren (Insekten) | pg/L, Pg/m3 |
Daraus folgt:
| 1 Vol.-% | = 10 000 ppm | = 10 000 000 ppb |
| 0,1 Vol.-% | = 1 000ppm | = 1 000 000 ppb |
| 0,01 Vol.-% | = 100 ppm | = 100 000 ppb |
| 0,001 Bol.-% | = 10 ppm | = 10 000 ppb |
| 0,0001 Vol.-% | = 1 ppm | = 1 000 ppb |
Umrechnung zwischen Volumen- und Gewichtsangaben
Diese Umrechnung ist sehr wichtig, da die anzeigenden Messgeräte in der Regel auf Volumenangaben (Vol.-% oder Vol.-ppm = ppmv)2 kalibriert werden und in verschiedenen Bereichen (z.B. Kraftwerk) Gewichtsangaben benötigt werden.
Geht man davon aus, dass ein Mol eines Gases unter Normalbedingungen (273 K und 1013 hPa) ein (Mol)-Volumen von 22,4 L einnimmt, so kann man darüber auf die Volumenkonzentration schließen. In Anwendungen 3 , bei denen ausschließlich in der Umgebungsluft bei 20°C gemessen wird, ändert sich das Molvolumen entsprechend auf 24,1L.
22,4 L ≅ molare Masse [g]
1 L ≅ molare Masse [g]/22,4 L
Befindet sich dieses Volumen (1 L) in einem Kubikmeter Luft so entspricht dies einer Volumenkonzentration von 1000 ppm.
1000 ppm ≅ molare Masse [g]/22,4 L pro m3
oder
1 ppm ≅ molare Masse [mg]/22,4 L
daraus lassen sich die folgenden Umrechnungsformeln ableiten:
Umrechnung von mg/m3 in ppm
(10) c[ppm] = · c[mg/m3]
Umrechnung von ppm in mg/m3
(11) c[mg/m3] = · c[ppm]
Unter Realbedingungen muss die allgemeine Gasgleichung eingesetzt werden, um das Molvolumen zu bestimmen.
(12) =
mit pr = raler Druck, Vr = Volumen, T3 = absolute Temperatur
wichtige relative Atommassen: Stickstoff (N) = 14, Schwefel (S) = 32, Sauerstoff (O) = 16, Kohlenstoff (C) = 12, Wasserstoff (H) = 1
Beispiel:
In einem Rauchgas befinden sich 135 ppm SO2 und 169 mg/m3 NO2. Es sollen die Konzentrationen in mg/m3 und ppm unter Normalbedingungen und unter Realbedingungen berechnet werden, wenn die Abgastemperatur 66°C bei einem Druck von 1179 hPa beträgt.
1. Umrechnung in mg/m3:
Die molare Masse von SO2 beträgt: 32g/mol(S) + 2x16g/mol (O)=64g/mol
Dieser Wert wird nun in Gl. 11 eingesetzt und man erhält:
c[mg/m3] = · 135 · 10-6 = 385,7 mg/m3
2. Umrechnung in ppm:
Die molare Masse von NO2 beträgt: 14g/mol (N)+2x16g/mol (O)=46g/mol
Dieser Wert wird nun in Gl.10 eingesetzt und man erhält:
c[ppm] = · 169 · 10-6 = 82,3 ppm
3.Unter Normalbedingungen ändert sich das Molvolumen wie folgt:
Vr = = 23,9 L
Die SO2 Konzentration in mg/m3 ändert sich daher wie folgt:
c[mg/m3] = · 135 · 10-6 = 361,5 mg/m3
Für die NO2 Konzentration gilt dann:
c[mg/m3] = · 169 = 158,4 mg/m3 Die Konzentrationen in ppm ändern sich unter Normalbedingungen nicht.
Im Internet gibt es auch Möglichkeiten diese Umrechnung online durchführen zu können: https://www.unternehmensberatung-babel.de/berechnungen/umrechnung-ppm.php
In der Erdgasindustrie sind Umrechnungen von Zusammensetzungsangaben für Gasgemische von großer Bedeutung, da sich die Druckbereiche von 1bar bis 1000 bar bewegen können. Das Realgasverhalten muss daher für diese Anwendungen berücksichtigt werden. In der DIN 1492 sind diese Zusammenhänge ausführlich beschrieben worden. https://www.smartsim.energy/gascalc/
1 Josef Loschmidt (1821-1895) österreichischer Physiker und Chemiker
2 die Angaben ppm und ppmv sind in der Gasanalyse identisch
3 z.B. bei der MAK-Wert Bestimmung